文献解读|单细胞多组学揭示异常剪接对人类造血分化的影响

英文标题:Single-cell multi-omics define the cell-type-specific impact of splicing aberrations in human hematopoietic clonal outgrowths
发表期刊:Cell Stem Cell
发表时间:2023.8.14
IF:23.9
研究背景
剪接因子是参与前体RNA剪接过程的蛋白质因子,SF3B1是编码剪接因子3b蛋白复合物的重要基因,其突变常发生在血液恶性肿瘤中,导致异常剪接位点的使用增加,并且这种异常剪接会导致转录本成为无义介导的mRNA衰变(NMD)的底物。SF3B1突变与骨髓增生异常综合征(MDS)的发病机制有关,然而其引起的异常剪接对人类造血分化的影响的分子机制尚不清楚。此外,SF3B1突变也增加了克隆性造血(CH,clonal hematopoiesis,一种血细胞类型的轻度异常增殖)患者发生髓系肿瘤的风险。本研究将GoT-Splice技术应用于SF3B1突变的MDS患者造血祖细胞,明确了体细胞突变对RNA剪接的细胞类型特异性的影响。
材料方法
本研究以未经治疗(MDS01-03)和治疗中(MDS04-06)MDS患者的CD34+骨髓祖细胞为研究对象,进行单细胞多组学测序。此外,为了克服技术限制,本研究开发了一种将转录组基因分型(GoT)与长读长单细胞转录组学和蛋白质组学结合起来,实现同时对转录组、表面蛋白、体细胞突变和RNA剪接进行分析的方法——GoT-splice,利用这种方法揭示SF3B1基因突变对MDS和CH患者造血分化的影响。
研究结果
1. GoT结合蛋白质组学揭示了SF3B1mut细胞在红系谱系中的富集与细胞周期和mRNA翻译基因的过表达有关
在骨髓增殖性肿瘤中,体细胞突变对转录组的影响随细胞身份的改变而变化,因此作者假设细胞身份和SF3B1突变之间的相互作用可能会导致MDS患者的造血分化中断。为验证这一假设,作者将GoT技术与单细胞蛋白质组学(CITE-seq)结合(图 1A),分别应用于3名未经治疗和3名治疗中MDS患者的CD34+骨髓祖细胞(图 1B)。整合6个MDS样本的转录组数据,绘制了CD34+祖细胞的分化图谱(图 1C)。
作者发现MUT细胞沿着红系分化轨迹积累,这表明SF3B1突变细胞频率(MCF)随着祖细胞亚型的变化而变化(图1D)。为证实该假设,评估了不同祖细胞类型的MCF,其中EPs(巨核细胞-红系谱系)中MCF最高,这与SF3B1突变具有红系特异性特征一致(图1E)。
随后分析了每个祖细胞亚群中MUT和WT细胞之间差异表达蛋白,结果显示CD38、CD99、CD36和CD71标记物在至少一种祖细胞类型中差异表达(图 1F)。利用这些红系成熟细胞表面蛋白标记物来验证红系成熟过程的拟时序分析,显示MCF随着红系成熟而增加,证实SF3B1mut细胞沿分化轨迹富集为预期的EPs(图1G)。进一步对SF3B1mut和SF3B1wt细胞进行差异基因分析,结果显示在突变的EPs中,编码重要翻译和核糖体生物发生因子相关的基因表达上调(图 1H)。
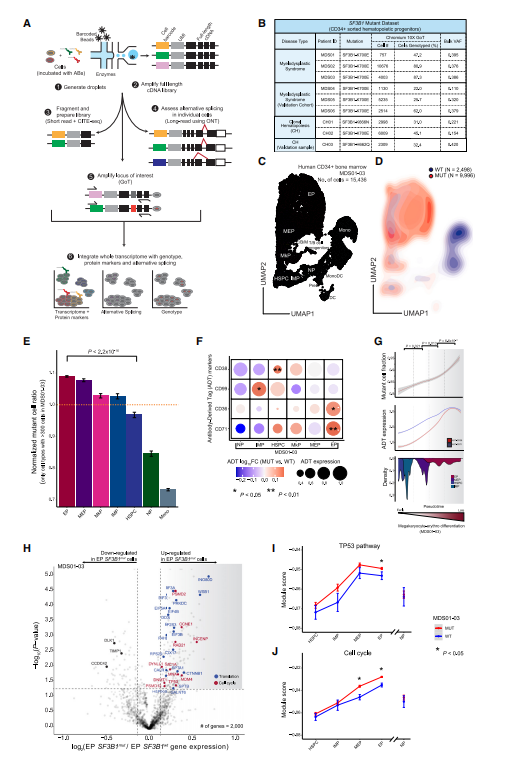
图1 巨核细胞-红系谱系SF3B1mut细胞的富集
2. GoT-Splice技术实现体细胞突变、可变剪接和细胞表型的综合分析
鉴于SF3B1在mRNA剪接中的关键作用,下一步探索了异常剪接如何将基因型和细胞表型联系起来。作者将GoT与ONT长读长测序相结合,实现了基因型、细胞表面蛋白质组和mRNA剪接位点信息的整合(即GoT-Splice技术,图1A)。与短读长测序和单独的ONT单细胞cDNA测序相比,GoT-Splice提供了高分辨率的单细胞全长转录组图谱(图2B-2C)。
为确保单细胞长读长测序准确识别剪接连接点,作者开发了一种利用SiCeLoRe分析的流程。通过比较短读长测序和长读长测序的数据,发现长读长测序检测到的连接点数量比短读长测序增加了12.3倍,其中大多数连接点(90%)是长读长数据(图 2D)。此外,与短读长测序的覆盖度具有3'端偏好相比,GoT-Splice提供了更好的覆盖均匀性(图 2E)。在MDS SF3B1mut细胞中观察到最常见的异常剪接事件(57%)主要是3'可变剪接位点(图2F),与先前的报道一致。在SF3B1mut细胞和SF3B1wt细胞之间差异的3'异常剪接位点中,其中87%在SF3B1mut细胞中使用频率更高(图2F)。
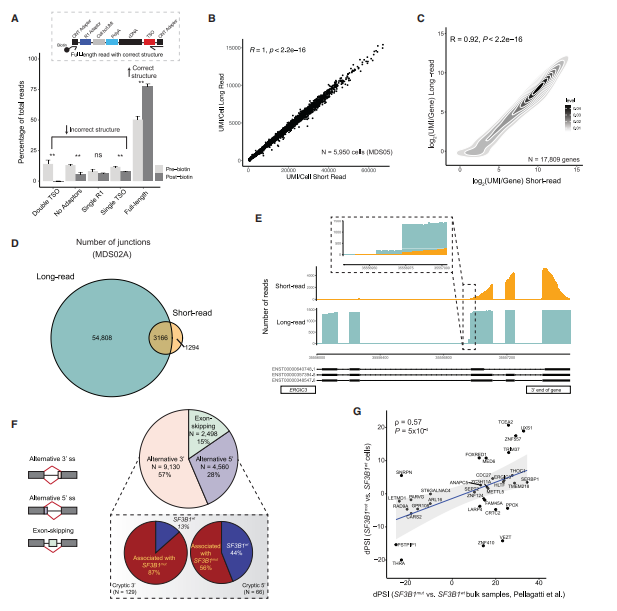
图2 同时分析基因表达、细胞表面蛋白标记、体细胞突变状态和单细胞分辨率下的可变剪接
3. GoT-Splice技术展现了SF3B1mut异常剪接的祖细胞的特异性模式
与之前的MDS研究一致,大多数由GoT-Splice鉴定的异常3'剪接位点位于正常3'位点上游的15-20bp(图3A-3B)。GoT-Splice的一个重要优势是能够在单细胞分辨率下检测剪接变化,从而可以比较特定细胞亚群中MUT和WT细胞之间的异常可变剪接(图3C)。
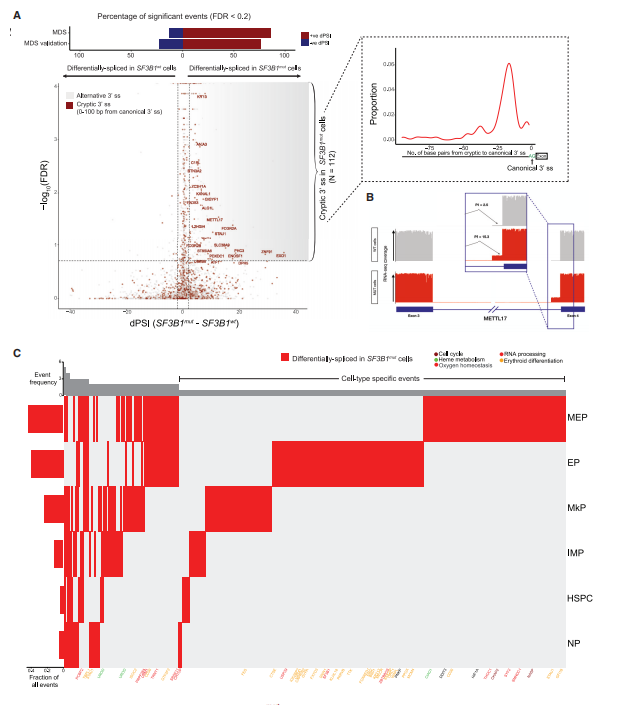
图3 SF3B1mut MDS中祖细胞类型特异性异常剪接
此外,红细胞生成是细胞状态的连续统一体,并依赖于沿分化轨迹发生的转录变化。SF3B1mut沿着这个连续体的异常剪接(图4A)揭示了一些红系分化,氧稳态和血红素代谢基因可能在EP成熟的早期阶段更频繁地异常剪接,而其它基因则在分化程度更高的EPs中显示异常剪接增加。
作者将MDS样本中检测到的异常3'剪接位点分为两大类:NMD诱导事件(引入PTC)和NMD中性事件。与NMD中性事件相比,MUT细胞含有的异常剪接转录本中,NMD诱导事件占比较少(图4C)。BAX是NMD中性事件影响红系分化的基因,也是TP53的转录靶点。BAX发生异常3'剪接产生的异构体BAX-ω,可以保护细胞免于凋亡(图4D)。
为了评估SF3B1mut中异常剪接产生的BAX异构体的功能和意义,作者构建了BAX和BAK1双敲除(DKO)的人TF-1红系白血病细胞,并在多西霉素诱导下生成了BAX-α、BAX-β和BAX-ω异构体(图 4E),探究在细胞因子缺失的条件下,不同异构体诱导细胞凋亡的能力。结果表明,BAX-ω在未成熟红细胞中具有抗凋亡的作用(图4F和4G)。以上表明SF3B1mut在红系分化基因中的NMD诱导事件和NMD中性事件是SF3B1mut MDS细胞发病机制中的重要事件。
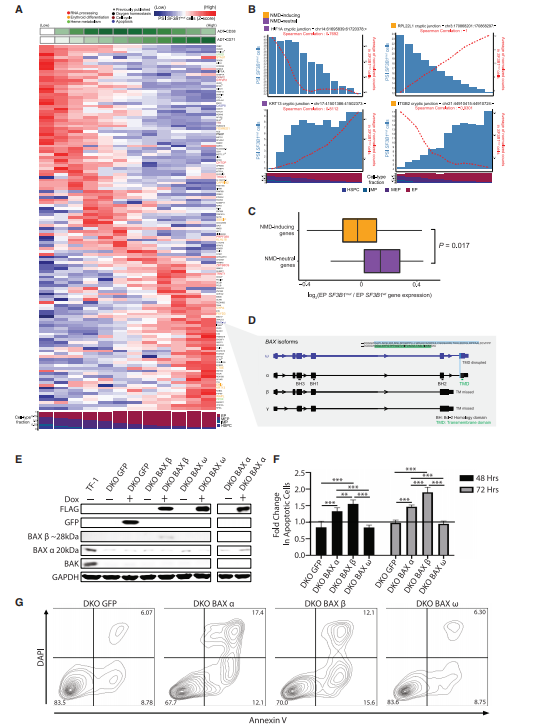
图4 SF3B1mut相关的异常剪接在红细胞生成过程中发生变化
4. SF3B1mut细胞在不同红系祖细胞中的累积和在CH患者中的异常剪接
此外,SF3B1突变与CH恶性转化的高风险密切相关,而剪接异常如何影响CH细胞表型目前尚不清楚。因此,作者从2个SF3B1突变的CH样本中分离出CD34+细胞进行GoT-Splice,并明确预期的祖细胞亚型(图 5A)。将基因分型信息映射到分化图谱上,显示SF3B1突变没有形成新的细胞身份(图 5B)。然而,拟时序分析显示,与SF3B1wt细胞相比,SF3B1mut细胞在较晚的伪时间点富集(图5C)。与SF3B1wt细胞相比,SF3B1mut细胞富含分化程度更高的EPs,表明SF3B1mut CH细胞已经显示出红系谱系偏向。
为进一步确定SF3B1mut CH细胞的转录失调,作者在MUT和WT细胞之间进行了差异表达基因分析。CH样本中SF3B1mut HSPCs(造血干细胞祖细胞)中参与mRNA翻译的基因上调(图5 E-F)。在CH中,mRNA翻译途径基因在多个细胞亚型中随红系分化而上调(图5G)。因此,尽管在CH个体中SF3B1突变未观察到明显的血细胞计数异常,但在疾病前期阶段,红细胞分化偏向和异常的转录谱已经较为明显。
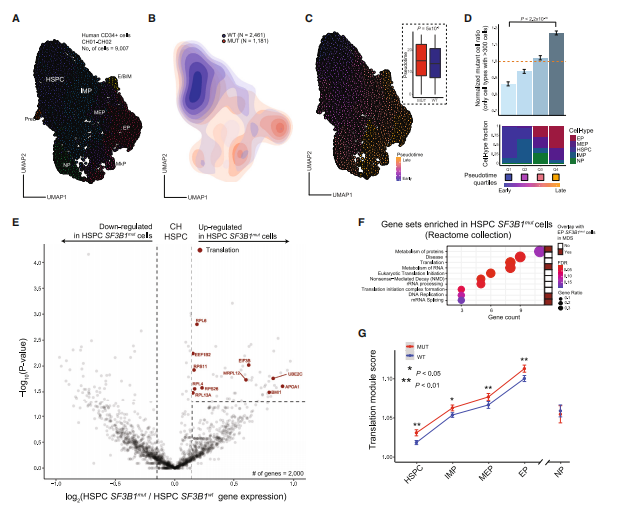
图5 SF3B1突变在克隆造血中沿红系富集
对SF3B1mut和SF3B1wt CH细胞间进行3'可变剪接位点差异分析,SF3B1mut细胞中3'剪接位点的使用显著增加(图6A)。为比较CH和MDS之间的异常剪接转录本,本研究比较了CH和MDS队列中至少一种红细胞分化轨迹细胞的异常3'剪接位点。虽然CH中显著的异常3'剪接位点的总数低于MDS,但共有异常剪接事件存在显著重叠(图6C)。同样,对于MDS,本研究发现了红系成熟过程中特定阶段的异常剪接事件,其中大多数与MDS的异常剪接位点重叠(图6D)。CH和MDS在BAX转录本中沿红系分化轨迹表现出相似的异常剪接动态(图6E)。
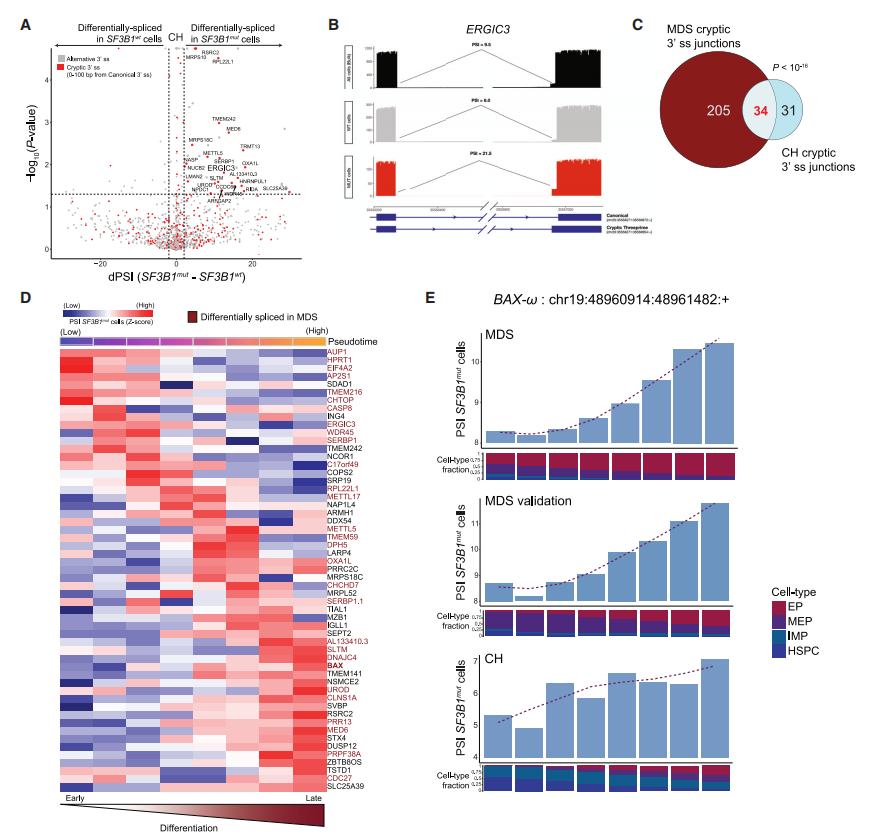
图6 SF3B1mut克隆造血祖细胞显示细胞类型特异性3'端异常剪接位点使用
研究总结
在研究MDS患者的造血祖细胞时,作者使用了GoT-Splice的技术,发现SF3B1发生突变的细胞在巨核细胞-红系中富集,并且SF3B1mut红系祖细胞会发生扩增。此外,不同祖细胞类型的细胞会使用不同的3'剪接位点,而且在红系分化过程中会发生阶段特异性异常剪接。对SF3B1突变的克隆造血样本的分析显示,SF3B1mut细胞中的红系偏向和细胞类型特异性3′剪接位点的使用先于MDS发生。这说明异常剪接在不同细胞类型中具有特异性的影响。GoT-Splice技术可以从早期克隆生长个体到明显的肿瘤中,检测体细胞突变对RNA剪接的细胞类型特异性的影响。
 027-62435310 |
027-62435310 |
 service@vikimarina.com |
service@vikimarina.com |



